Matéria
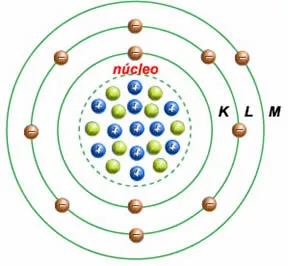
Toda a matéria conhecida no universo é composta por partículas subatômicas chamadas átomos. O átomo, que é a menor unidade de um elemento químico que mantém as propriedades desse elemento, é composto por um núcleo central denso contendo prótons e nêutrons (bárions) e é cercado por elétrons (léptons). Segundo o modelo proposto por Niels Bohr, os elétrons orbitam o núcleo em camadas ou níveis de energia definidos. Esse modelo foi um dos primeiros a descrever a estrutura atômica de forma quantitativa, mas não é completamente preciso.
A mecânica quântica moderna, que se desenvolveu posteriormente, descreve os elétrons em termos de funções de onda, onde eles não têm trajetórias definidas como no modelo de Bohr, mas são representados por orbitais que indicam as regiões onde é mais provável encontrar um elétron.


Camadas eletrônicas e Camadas de Valência:
Os elétrons em um átomo, segundo o modelo de Bohr, estão organizados em diferentes níveis de energia ou “camadas eletrônicas”, que são como as órbitas que eles seguem ao redor do núcleo. Essas camadas são numeradas de 1 (mais próxima do núcleo) em diante. A camada de valência é a camada mais externa ocupada pelos elétrons. Esses elétrons são os responsáveis pelas ligações químicas, e a tendência dos átomos de completar sua camada de valência com oito elétrons é chamada de “regra do octeto”. Átomos com camadas de valência incompletas são mais reativos e tendem a se ligar com outros átomos para alcançar a estabilidade.
Teoria quântica
A teoria quântica, fundamental para a física moderna, descreve o comportamento de partículas subatômicas, como elétrons. No modelo atômico quântico, os elétrons não seguem órbitas fixas, mas existem em regiões de probabilidade chamadas orbitais, onde há uma chance de encontrar um elétron. Esses orbitais têm diferentes formas e representam a distribuição dos elétrons ao redor do núcleo, formando uma nuvem de elétrons.
No contexto do modelo quântico, as camadas eletrônicas são interpretadas como níveis de energia que podem conter um número máximo específico de elétrons. Cada camada eletrônica é associada a um conjunto de orbitais, e a camada de valência refere-se à camada mais externa, que é crucial para as interações químicas. Os elétrons nessa camada de valência são os responsáveis pela formação de ligações químicas, e sua disposição determina a reatividade dos átomos.
Esse modelo foi aprimorado a partir do trabalho de Niels Bohr, que propôs que os elétrons orbitam o núcleo em níveis de energia quantizados. Embora Bohr tenha introduzido a ideia de camadas de energia, o modelo quântico fornece uma compreensão mais detalhada, onde os elétrons ocupam orbitais dentro dessas camadas, cada um com uma forma e energia específicas. Ao absorver ou emitir energia, os elétrons podem saltar entre esses níveis, resultando em espectros de emissão característicos para cada elemento.

Algumas propriedades dos átomos:
- Número atômico (Z): representa o número de prótons no núcleo de um átomo e define o elemento químico
- Massa atômica (A): representa a soma do número de prótons e nêutrons no núcleo do átomo
- Isótopos: representa átomos de um mesmo elemento que possuem diferentes números de nêutrons
Átomos podem se combinar para formar molécula através de ligações químicas. Existem vários tipos de ligação química, incluindo:
- Ligações covalentes: onde os átomos compartilham pares de elétrons para alcançar a estabilidade eletrônica.
- Ligações iônicas: onde um átomo doa um ou mais elétrons para outro átomo, resultando na formação de íons que se atraem devido às suas cargas opostas.
- Ligações metálicas: onde os átomos em um metal compartilham uma “nuvem” de elétrons livres que se movem ao redor dos núcleos atômicos, conferindo propriedades como condutividade elétrica e maleabilidade.

Breve história da descoberta atômica:
- Demócrito (c. 460 – c. 370 a.C.): Primeiro filósofo a sugerir que a matéria é composta de partículas indivisíveis chamadas “átomos”.
- John Dalton (1766–1844): Desenvolveu a teoria atômica moderna, postulando que cada elemento é composto por átomos de um único tipo. Propôs que o modelo atômico seria semelhante a uma bola de bilhar, onde os átomos são esferas sólidas e indivisíveis.
- Joseph John Thomson (1856-1940): Descobriu o elétron em 1897 através de experimentos com raios catódicos. Propôs um novo modelo atômico, conhecido como o modelo “pudim de passas”. Segundo este modelo, o átomo seria uma esfera de carga positiva na qual os elétrons, que são partículas de carga negativa, estariam distribuídos como passas em um pudim.
- Ernest Rutherford (1871–1937): Descobriu o núcleo atômico através do experimento de dispersão de partículas alfa. Propôs que o modelo atômico seria semelhante a um sistema solar, em que o núcleo representaria o Sol e os elétrons que orbitam ao redor desse núcleo seriam os planetas que orbitam ao redor do Sol.
- Niels Bohr (1885–1962): Propôs o modelo de átomos com elétrons orbitando o núcleo em níveis de energia definidos. Este modelo, conhecido como o modelo de Bohr, sugeria que os elétrons se movem em órbitas circulares ao redor do núcleo sem perder energia.
- Mecânica quântica (década de 1920): Com o desenvolvimento da teoria quântica, o modelo atômico passou a ser interpretado de forma diferente. Em vez de órbitas circulares fixas os elétrons passaram a ser descritos como existindo em regiões de probabilidade chamadas orbitais, formando uma nuvem de elétrons ao redor do núcleo. O modelo quântico explicou de maneira mais precisa as interações atômicas e o comportamento dos elétrons, levando em conta sua dualidade onda-partícula e os princípios de incerteza.
O link acima redireciona para uma página produzida para um curso da UFRGS que fala da constituição do Universo e do seu futuro. Trata de temas interessantes que ainda não podem ser explicados, como a energia e a matéria escura.
O link acima redireciona para um experimento online fornecido pelo PhET (website desenvolvido pela Universidade do Colorado em Boulder). Este experimento permite que o visitante monte um átomo juntando prótons, elétrons e nêutrons, além de um minijogo sobre elementos químicos e suas propriedades básicos.
